MAT法热原检测中,非内毒素热原(NEP)对照品设为 “选做”,且试剂盒不默认配备,需结合检测需求灵活使用,背后有明确的设置逻辑。首先,试剂盒开发阶段已通过验证(用多种 NEP 配体刺激细胞),证明其可检出 NEP,后期实验是否加入 NEP 对照,只需根据内部管理要求或专业人员建议确定,无需强制设置;若产品产线明确无 NEP 污染风险(如只使用革兰氏阴性菌原料),可删除 NEP 对照,简化操作。其次,试剂盒不配备 NEP 对照品,是因不同用户需求差异大 —— 部分用户需检测特定 NEP(如脂磷壁酸),部分需检测广谱 NEP,因此提供单独购买选项,用户可按需选择,避免资源浪费。NEP 对照品的主要使用场景包括:一是方法验证阶段,用于确认试剂盒对 NEP 的响应性;二是产品工艺变更后,排查是否引入 NEP 污染;三是欧盟申报时,需证明方法可覆盖 NEP,此时需加入 NEP 对照品并显示阳性结果。若样品检测中 NEP 对照品阳性,而样品检测阴性,可排除 NEP 污染;若样品阳性,则需进一步鉴定热原类型。
热原检测采用人外周血单核细胞(PBMC),优势是天然受体谱系完整,但供体差异导致变异系数(CV)高达25%。北京血液制品热原检测欧盟出口方案
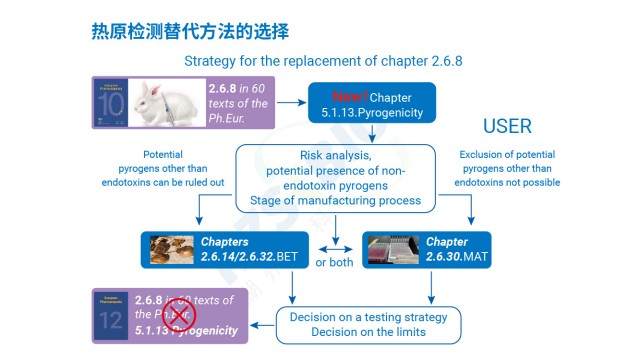
热原是指微量即可引发恒温动物体温异常升高的物质,分为内源性(如细胞因子)与外源性两类,外源性热原又涵盖微生物来源(革兰氏阴性菌脂多糖 LPS、革兰氏阳性菌脂磷壁酸 LTA、病毒、真菌等)与非微生物来源(灰尘、橡胶降解产物等)。传统细菌内毒素检查法(BET)只能检测革兰氏阴性菌的 LPS,无法覆盖非内毒素热原,而单核细胞活化试验(MAT)可弥补这一缺陷。其原理是:热原通过活化单核细胞表面的 Toll 样受体(TLR,如 TLR4 识别 LPS、TLR2/TLR6 识别 LTA),启动先天免疫反应,促使细胞释放 IL-6、TNF-α 等促炎细胞因子;随后采用 ELISA 法检测 IL-6 浓度,结合 LPS 标准曲线推算样品中总热原含量,实现对内毒素与非内毒素热原的同步检测,契合《中国药典》9301 指导原则中 全场景防控热原风险”的要求。
疫苗热原检测技术升级单核细胞活化试验MAT通过量化人源单核细胞的免疫应答,实现对LPS、脂磷壁酸、β-葡聚糖的同步检测。
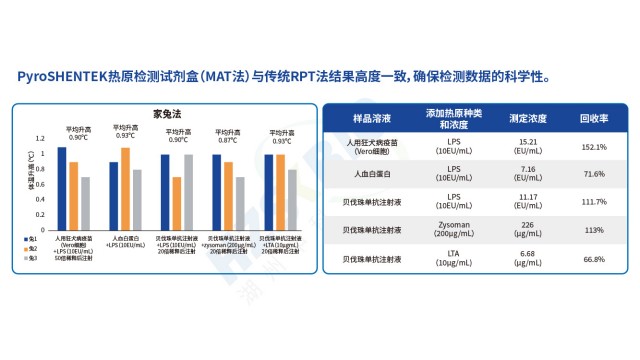
MAT 法与传统家兔法在热原检测中,性能差异明显,MAT 法在准确性、效率与合规性上更具优势。从结果评判来看,MAT 法以 “加标回收率 50%-200%、供试品浓度 < 规定限值(CLC)” 为合格标准,灵敏度达 0.0125EU/mL,可准确定量热原浓度;而家兔法只能定性(观察体温升高),灵敏度低(约 0.1-0.5EU/mL),易因家兔个体差异(如免疫状态、应激反应)导致假阴性。从检测效率来看,MAT 法样品与细胞共培养 24 小时即可出结果,且可批量检测(96 孔板一次处理多个样品);家兔法需连续观察 72 小时,每次只能检测少量样品,耗时且人力成本高。从合规性来看,MAT 法不使用动物,符合 3R 原则,已被欧盟接受(EP 删除家兔法);家兔法因动物实验属性,面临欧盟等地区的法规限制。此外,MAT 法重复性优(复孔 CV 可控制在 30% 以内),家兔法因个体差异 CV 常超 50%,进一步凸显 MAT 法在现代热原检测中的优势。
生物制品(如单克隆抗体、重组蛋白、细胞因子)因基质成分复杂(含高浓度蛋白质、螯合剂、表面活性剂、缓冲盐等),在热原检测过程中易出现“反应抑制”或“非特异性增强”现象,严重影响检测结果准确性。选择抗干扰能力更强的检测方法至关重要,重组级联试剂(rCR)因采用完整级联反应路径,抗干扰性优于天然 LAL;单核细胞活化反应测定(MAT)对复杂基质耐受性更高,通过适当稀释即可消除多数干扰,因此生物制品热原检测常采用 “rCR 法(内毒素定量)+ MAT 法(全热原筛查)” 的联合方案,既保证内毒素检测的准确性,又防控非内毒素热原风险。
热原具有顽强稳定性、耐热性(180℃/2h才能破坏)、水溶性、滤过性,可穿透常规灭菌屏障。
湖州申科生物热原检测试剂盒(MAT 法,货号 1502100)包含完整的检测体系,组分按功能可分为细胞培养类、ELISA 检测类与辅助类,且储存条件明确。细胞培养类组分包括:2-8℃储存的培养液(25mL×2 瓶)、96 孔细胞孵育板,-18℃储存的培养液添加剂(1.5mL×1 管)、细菌内毒素工作标准品,以及需液氮保存的 MAT 细胞(2 支),确保细胞活性与稳定性。ELISA 检测类组分涵盖:2-8℃储存的生物素偶联抗 IL-6 抗体(200×,60μL)、链霉亲和素 HRP 复合物(100×,140μL)、TMB 显色液(12mL)、终止液(6mL),以及抗 IL-6 预包被酶标板(8 孔 ×12 条),无需额外制备抗体,即开即用。辅助类组分包括细菌内毒素检查用水(8mL×1 管)、稀释液(25mL)、浓缩缓冲液(10×,25mL×2 瓶)与封板膜,满足从样品稀释到检测终止的全流程需求。各组分储存条件严格区分,避免因储存不当导致性能下降,保障检测结果可靠。
鲎试验法(LAL)法进行热原检测灵敏度高、操作方便,但只针对内毒素,易受干扰且有 LER 现象。陕西热原检测风险评估
热原有广谱来源特征,革兰阴性菌(内毒素/LPS)致热能力强,革兰阳性菌、真菌、病毒均可产生。北京血液制品热原检测欧盟出口方案
MAT 法热原检测标曲采用非倍比稀释,而非 1-0.5-0.25 的倍比稀释,主要优势在于提升标曲准确性与适用性,避免稀释误差影响。一是可密集覆盖关键浓度区间:热原检测的重点关注区为低浓度拐点(如 0.0125-0.1EU/mL)与高浓度平台区(如 0.5-1EU/mL),非倍比稀释可在这些区间设置更多浓度点(如 0.0125、0.025、0.05、0.1、0.25、0.5、1EU/mL),提升曲线拟合精度,而倍比稀释低浓度点少,易导致低浓度热原定量不准。二是降低稀释误差累积:倍比稀释需连续稀释(如 1EU/mL→0.5EU/mL→0.25EU/mL),每一步误差会累积,导致低浓度点实际浓度偏离理论值;非倍比稀释通过单独配制每个浓度点(如直接用标准品配制 0.025EU/mL),避免误差累积,提升标曲可靠性。三是适配不同样品浓度:非倍比稀释可根据样品预期浓度调整标曲范围,如样品预期浓度 0.05EU/mL,可增加 0.025、0.05、0.1EU/mL 点,确保样品浓度落在标曲线性区,而倍比稀释范围固定,灵活性差。这些优势使非倍比稀释成为 MAT 法标曲配制的优先选择方式。
北京血液制品热原检测欧盟出口方案