宿主细胞蛋白(HCP)作为生物制品中来源于细胞基质的残留杂质,具有明显的异质性特征。其复杂性体现在三个方面:①理化特性差异:HCP涵盖胞内及分泌蛋白,涉及关键生理功能,具有涵盖区间大的等电点(pI 3-11)、分子量范围(5-250kDa)及疏水性;②上游工艺影响:不同发酵工艺(如细胞株、培养条件)诱导独特的翻译后修饰(PTM),导致HCP总量与生化复杂性增加;③下游工艺与产物特性干扰:抗体、细胞因子等重组蛋白或病毒类药物的纯化工艺会选择性残留特定HCP,且产物形式(如大肠杆菌的包涵体/可溶性表达)直接影响HCP残留谱。针对特定生产工艺开发定制化检测方案是准确监控宿主细胞蛋白残留的关键。
HCP 定制化开发需构建成熟平台、技术实力、合规体系、稳定供应、专业团队及成功案例的全维度支撑体系。广东定制化宿主细胞蛋白(HCP)残留检测免疫策略
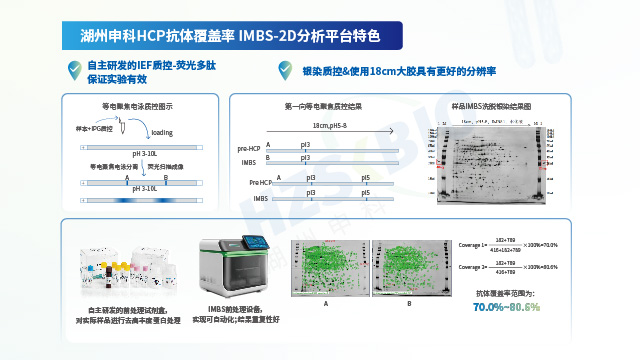
湖州申科采用免疫磁珠分离(IMBS)结合 2D 电泳或者 LC-MS 的方法评估抗体覆盖率。IMBS主要流程包括多克隆抗体与磁珠偶联,磁珠未结合位点的封闭,HCP样本与结合抗体的磁珠共同孵育,此过程中 HCP 抗体结合可以识别的 HCP,而未识别的 HCP 则通过后续洗涤步骤去除,再通过低 pH等洗脱条件收集抗体捕获的HCP。该方法拥有 AAE(Antibody Affinity Extraction)免疫层析柱分离的所有优点,同时免疫磁珠可以在悬浮的条件下与 HCP样品充分混匀结合,HCP结合效果更佳,由于采用磁珠吸附可以减少 HCP与填料的非特异性吸附,提高实验准确性。
浙江生物制品宿主细胞蛋白(HCP)残留检测抗体制备在生物制品质控领域需要基于产品特性与风险分析,聚焦关键质控点开发宿主蛋白残留检测方法。
对于HCP抗体的纯化方法,目前美国药典1132章节推荐有两种方式,包括protein A或protein G亲和柱层析法和HCP抗原亲和柱层析法。两种方法各有优缺点,均符合监管的要求。在实际使用过程中,这对不同产品可能会导致检测结果的差异。两者方法得到的抗体主要区别是HCP抗体有效含量的占比。HCP抗原亲和柱层析法显然占比高,但是也存在某些HCP抗体丢失的情况,这也会导致针对某些样本的检测结果比前者偏低,需要企业在实际方法建立时进行充分的评估。HCP抗原亲和柱层析法对纯化工艺要求更高,为保证抗体批间一致性,需要重点考察HCP抗原柱制备工艺、柱子的使用寿命、再制备的一致性等问题。
湖州申科生物结合不同宿主实际的生产工艺,通过高质量免疫原和 HCP 多抗的标准化制备流程,获得高效价、高覆盖率的抗体,开发了适用于大肠杆菌表达菌 (BL21) 生产工艺、克隆菌碱裂法提取质粒工艺的 SHENTEK®E.coli HCP检测试剂盒, 适用于CHO\MDCK\HEK293\Sf9\VERO\毕赤酵母等不同宿主的 HCP 检测试剂盒。用于中间品、原液及终产品等的HCP定量监测。为确保 ELISA 对HCP定量检测的准确性,须对 HCP 抗体覆盖率进行验证。湖州申科抗体覆盖率平台采用2D Clean-up 试剂盒去除蛋白样品的干扰物(洗涤剂、盐、脂质、酚类和核酸等离子污染物),并设置2D 质控标准品进行严格质控,同时以阴性抗体为对照平行试验,以提高结果准确度。
基于HCP的复杂性,检测中常遇到中间品,尤其是原液样品无法达到稀释线性,可能与样品基质的干扰有关。
针对宿主细胞蛋白残留检测,工艺特异型检测试剂盒(upstream-process)专为特定生产工艺设计,其关键在于使用产物的实际宿主细胞进行开发与验证,模拟真实生产流程获取广谱HCP抗原,并要求抗血清具备高度覆盖率以适应工艺变动,确保对特定生产流程残留的高度准确监控。平台型检测试剂盒(platform)则由生产商针对其特定表达宿主细胞和相近工艺自行开发,其优势在于可使用相同的参考标准品和试剂统一监测在该宿主上生产的不同产品,适用于上游工艺足够相似的产品线。通用型检测试剂盒(commercial)则作为市售广谱方案,适用于相似宿主细胞的常规检测,但因其制备过程可能无法完全模拟目标产物的实际生产,必须严格评估多克隆抗体对特定产品HCP的覆盖率,以保证检测可靠性。三类试剂盒覆盖从深度定制到通用筛查的不同需求。
湖州申科HCP试剂盒开发经抗原表征、抗体制备到体系验证,全流程符合法规要求。广东ELISA法宿主细胞蛋白(HCP)残留检测桥接验证
HCP 检测试剂盒开发要兼顾法规合规、物料充足稳定、团队专业响应与案例积累,形成系统性保障能力。广东定制化宿主细胞蛋白(HCP)残留检测免疫策略
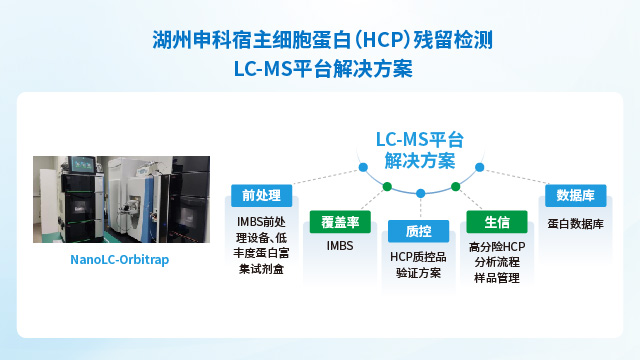
LC-MS技术作为生物制品宿主细胞蛋白残留检测新趋势,需考虑以下几点:①稳定性:需要HCPs LC-MS检测流程进行验证,全流程都需要有严格的QC控制,确保检测结果的一致性和稳定性。②可重复性:不同类型生物制品中HCPs提取效率不同,不同人员操作存在差异,需要在上机前通过不同方法评估HCPs的提取效率,避免人为因素造成结果重复性差。③准确度:方法开发与验证阶段,通过设立内标与定量算法,根据内标响应回算得到HCPs的含量,确保定量结果的准确性。④抗干扰能力:高丰度蛋白和特殊基质会对质谱检测产生影响,需要通过前处理手段对高丰度蛋白或特殊的基质进行去除,以减少其对HCPs肽段在质谱检测时的影响。⑤真实性:样品中除HCPs以外的物质在质谱分析中同样会产生质谱信号,需要去除复杂的背景噪音避免假阳性和假阴性的出现,建立合理标准的生信分析流程。分析流程建立过程中同样需要建立严格的质控QC标准,并通过后期不同方法进行验证,确定其标准的真实性。
广东定制化宿主细胞蛋白(HCP)残留检测免疫策略