生物制品的临床前安全性评价是药物研发的关键环节,其主要目标在于通过系统化的实验设计,预测药物在人体中的潜在风险,为临床试验提供科学依据。以疫苗为例,其安全性评价需贯穿原辅材料控制、生产工艺验证、理化性质检定、动物试验及临床前监测全流程。动物试验作为主要手段,需模拟人体免疫应答,重点考察疫苗对免疫organ(如胸腺、脾脏)及靶organ(如肝脏、肾脏)的影响,评估毒性可逆性及超敏反应风险。例如,流感疫苗的临床前研究需通过豚鼠主动过敏试验,预测其引发Ⅰ型超敏反应的可能性;而PD-1抑制剂等tumor免疫医疗药物,则需通过非人灵长类动物模型,验证其阻断免疫检查点后的自身免疫风险。评价体系构建需遵循“具体问题具体分析”原则,结合药物作用机制、种属特异性及临床适应症设计试验。对于细胞因子类药物,需考虑其多向性、网络性效应可能引发的“瀑布效应”,如重组人促红的细胞生成素可能同时纠正贫血与促进tumor生长的双重风险。此外,杂质控制是安全性评价的重要环节,宿主细胞蛋白质、DNA残留及内jisu等工艺相关杂质,可能通过免疫复合物沉积导致损伤,需通过纯化工艺优化及质控标准制定降低风险。选择环特生物的临床前服务,为新药研发筑牢坚实基础。深圳抑制剂临床前安全评价实验室

环特生物的安全性评价体系聚焦于早期毒性预测与机制解析,通过斑马鱼胚胎毒性测试(ZET)、类organ毒性模型及计算毒理学方法,实现“安全窗口”前移。斑马鱼胚胎因其透明性,可直观观察化合物对心脏发育、神经管形成等organ发生过程的影响,例如在抗癫痫药物开发中,ZET检测发现某候选分子在10μM浓度下即可导致斑马鱼胚胎心脏循环障碍,提示潜在心脏毒性风险。类organ毒性模型则通过模拟人体组织对化合物的代谢启动过程,揭示肝毒性或肾毒性的分子机制,如某激酶抑制剂在肝类organ中诱导线粒体损伤,导致谷丙转氨酶(ALT)水平升高,该结果与临床前猴模型数据高度一致。计算毒理学通过定量构效关系(QSAR)模型和机器学习算法,预测化合物对特定靶organ的亲和力,例如基于ADMET(吸收、分布、代谢、排泄、毒性)预测平台,提前排除具有hERG通道抑制风险的化合物,避免后期临床试验中的心脏安全性问题。宁波呼吸临床前评价临床前用斑马鱼高通量筛选,短时间锁定有潜力的抗tumor先导物。
代谢性疾病(如糖尿病、肥胖、脂肪肝)的高发,推动了相关药物的研发需求,而体系化的临床前研究是药物研发成功的保障。杭州环特生物科技股份有限公司构建了覆盖多种代谢性疾病的临床前研究体系,为药物研发提供全流程支持。在临床前模型构建方面,通过高脂饲料诱导、基因编辑等方式,构建斑马鱼与哺乳动物代谢性疾病模型,模拟疾病的病理特征;在药物筛选中,利用斑马鱼模型的高通量优势,快速筛选具有降糖、降脂、jianfei等功效的候选药物;在药效验证中,通过分子生物学检测、行为学分析等,深入评估药物的医疗效果与作用机制;在安全性评价中,多方面检测药物对代谢organ(如肝脏、胰腺)的潜在影响。环特生物的体系化临床前研究服务,为代谢性疾病药物研发提供了高效、多方面的支撑。
对新药临床前毒理学研究结果的准确分析与解读直接关系到新药研发的决策。在分析毒理学数据时,首先要关注各项观察指标的变化趋势,不仅只是某个时间点的数值。例如在长期毒性试验中,体重变化曲线若呈现持续下降趋势,可能意味着药物对动物的营养代谢产生了不良影响,需要进一步深入分析原因。同时,要对不同剂量组之间的数据进行对比,判断剂量 - 反应关系是否存在。若随着药物剂量的增加,毒性反应的发生率和严重程度也相应增加,那么这种剂量 - 反应关系的存在提示药物毒性与剂量密切相关。此外,对于一些异常的检测结果,不能孤立地看待,需要综合考虑动物的整体状况、其他相关指标的变化以及试验过程中的各种因素。例如,血液生化指标中某个酶活性的升高,可能是药物直接作用于肝脏细胞导致,也可能是由于动物在试验过程中受到应激等其他因素干扰。只有通过多方面、系统、科学的分析与解读,才能从毒理学研究结果中提炼出真实、准确的信息,为新药能否进入临床试验以及后续的研发方向提供合理的判断依据。环特生物的临床前实验服务,覆盖药效筛选、毒理测试等领域。
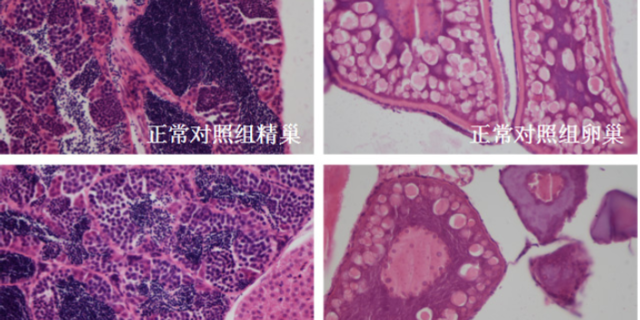
动物毒理实验是化合物临床前研究中保障安全性的关键环节。实验需选用合适的动物模型,如大鼠、小鼠、豚鼠等,根据化合物预期的临床用途和给药途径,设计不同剂量组进行长期或短期给药。期间密切观察动物的一般行为表现、体重变化、饮食情况等,定期采集血液、组织样本进行血常规、血生化、病理组织学检查。例如,通过长期毒性实验,可发现化合物对动物肝脏、肾脏、心脏等重要organ是否造成损伤及损伤程度,确定其无毒性反应剂量和比较大耐受剂量。急性毒性实验则能快速评估化合物单次大剂量给药后的毒性反应,如是否引发急性死亡、惊厥等严重不良反应。这些毒理实验数据为确定化合物在人体临床试验中的安全起始剂量和剂量递增方案提供重要参考,很大程度降低人体用药风险。临床前研究可有效降低新药研发风险,提升研发成功率。北京国家认可临床前毒性检测方法
营养补充剂临床前,投喂斑马鱼,依生长数据,判断产品营养功效。深圳抑制剂临床前安全评价实验室
医疗器械的安全性直接关系到患者生命健康,临床前安全性评价是医疗器械上市前的重要环节。杭州环特生物科技股份有限公司针对医疗器械的特点,提供符合法规要求的临床前安全性评价服务。根据医疗器械的使用场景与接触方式,临床前研究需开展相应的安全性检测,例如植入式医疗器械需进行生物相容性评价、长期毒性测试;体外诊断试剂需进行特异性、灵敏度验证。在临床前研究中,通过斑马鱼模型、哺乳动物模型等,模拟医疗器械在体内的作用过程,评估其对组织organ 的影响;同时,严格遵循ISO、GB等相关标准,确保临床前研究数据的合规性与可靠性。环特生物的临床前安全性评价服务,帮助医疗器械企业满足上市要求,保障产品的临床使用安全。深圳抑制剂临床前安全评价实验室