-
01.07 2026
浙江INDeCTD找哪家 GDUFAIII框架与费用分类2022年更的GDUFAIII将费用分为ANDA申请费、DMF认证费、项目费及设施费四类,实施周期至2027年。2025财年ANDA费用长至约22万美元,较2...
查看详细> -
12.19 2025
安徽ANDAeCTD医疗科技 经济影响与成本效益尽管初期T入较高(平均每企业需50万欧元),但eCTD可减少30%的审评延迟成本,长期效益。仿制YAO企业通过eCTD复用原研数据,节省80%的申报准备时间。欧盟预算拨款...
查看详细> -
12.18 2025
闵行区原料药eCTD服务电话 危机应对与应急递交机制在公共卫生紧急事件(如COVID-19)中,EMA允许简化eCTD序列,优先审评关键模块并暂缓非数据。申请人可通过快su通道(FastTrack)提交yi苗或yao物...
查看详细> -
12.16 2025
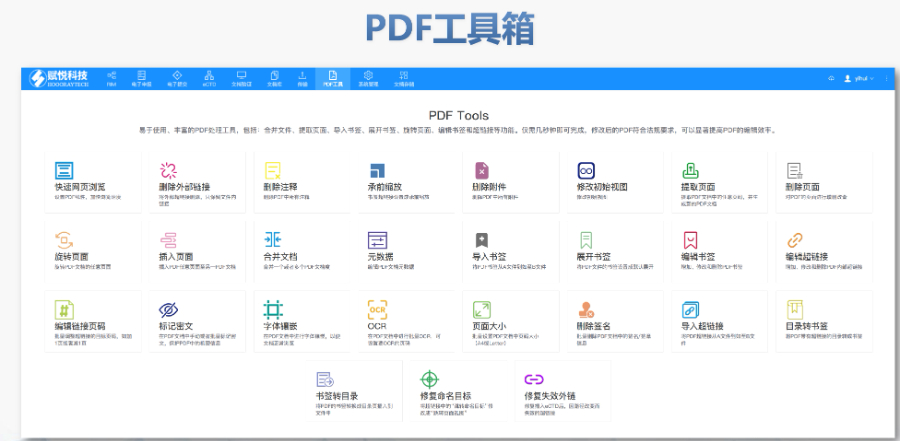
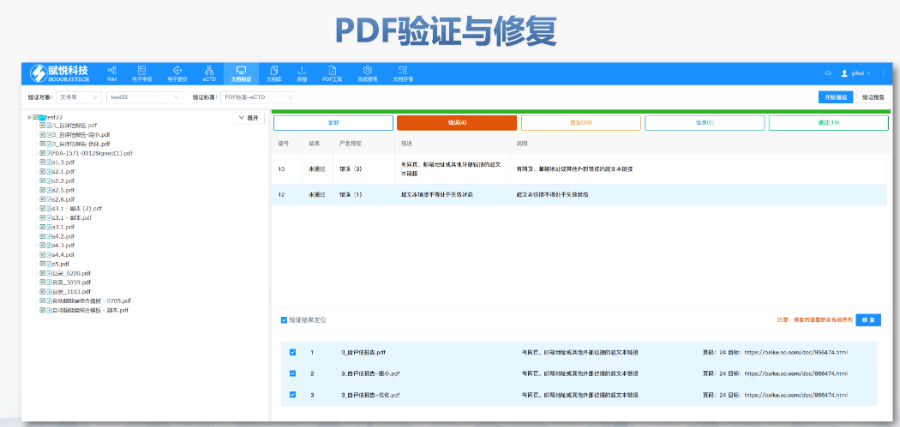
太仓CDE eCTD软件 eCTD即是电子化的CTD注册申报方式,相对于传统的纸质递交,eCTD电子递交更便捷、更安全。对于申请者来说,一个产品如在多个市场递交,M2-M5的资料可以共享,极大降低了成本并提高了效率...
查看详细> -
12.15 2025
安徽国产eCTD服务介绍 争议解决与法律救济若申请人对审评结果有异议,可向EMA的CHMP申请重审查,或在欧盟法院提起行政诉讼。eCTD的完整提交记录可作为法律证据,证明申请人已履行合规义务。EDQM设立仲裁wei...
查看详细> -
11.19 2025
高新区CDE eCTD品牌 生命周期管理与变更递交eCTD支持全生命周期管理,申请人需通过序列更(Sequence)反映yao品变更信息。例如CEP的更需提交“变更说明表”,对比已批准和拟修改内容,并附修订版技术文档...
查看详细> -
07.16 2025
芜湖药品注册eCTD名称 美国电子提交通道ESG(Electronic Submissions Gateway)是美国食品药品监督管理局(FDA)建立的电子化监管信息提交系统,旨在为制药、生物制品、医疗器械等行业提供安全、高效...
查看详细> -
05.14 2025
原料药eCTD格式 欧盟eCTD的历史沿革与强制实施 欧盟自2003年逐步推进eCTD(电子通用技术文档)的标准化进程,初要求药注册申请(MAA)采用CTD格式。2010年,集中审评程序(CP)率先强制使用eCTD,随后...
查看详细> -
04.25 2025
宁波药品注册eCTD服务价格 eCTD在欧盟药品监管中的历史背景:欧盟eCTD(电子通用技术文档)的发展始于对临床试验和药品审评流程标准化的需求。2001年,欧盟引入《临床试验指令》(CTD)作为统一的法律框架,但其分散的成员国申...
查看详细> -
04.22 2025
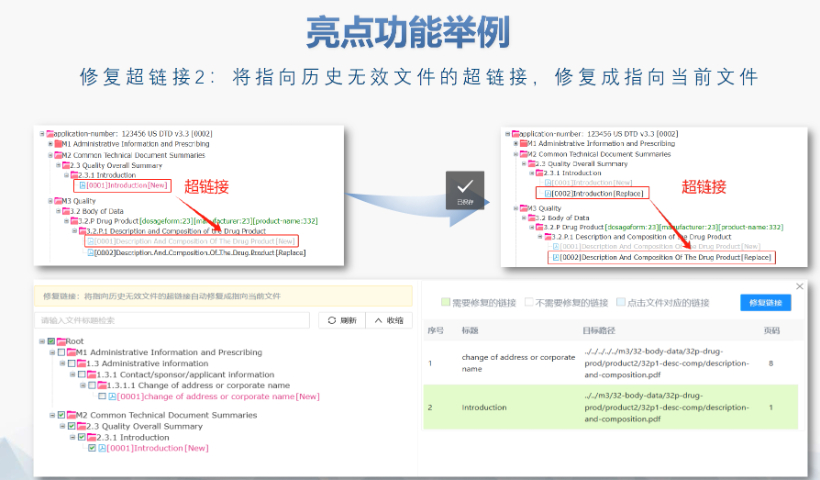
吴江区国产eCTD医疗科技 文件生命周期管理:eCTD支持文件替换(Replace)、删除(Delete)等操作,而非增文件。例如,更临床研究方案时需用Replace操作覆盖旧版本。基线提交(Baseline Submissio...
查看详细> -
04.19 2025
西藏eCTD软件 经济影响与成本效益 尽管初期投入较高(平均每企业需50万欧元),但eCTD可减少30%的审评延迟成本,长期效益。仿制药企业通过eCTD复用原研数据,节省80%的申报准备时间。欧盟预算拨款2亿欧元资助中...
查看详细> -
04.16 2025
芜湖原料药eCTD名称 申报流程与要求 资料准备 内容要求:包括产品描述、生产工艺(原材料来源、设备参数等)、质量控制标准(SOP、稳定性数据)、安全性与毒性研究等。 格式规范: 采用CTD(通用技术文件)格式,按模块...
查看详细>