- 品牌
- 司鼎;OriCell
聚合酶链式反应的试验污染:PCR扩增产物污染:这是PCR反应中很主要很常见的污染问题。因为PCR产物拷贝量大(一般为1013拷贝/ml),远远高于PCR检测数个拷贝的极限,所以极微量的PCR产物污染,就可形成假阳性。还有一种容易忽视,很可能造成PCR产物污染的形式是气溶胶污染。在空气与液体面摩擦时就可形成气溶胶,在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样的反复吸样都可形成气溶胶而污染。据计算一个气溶胶颗粒可含48000拷贝,因而由其造成的污染是一个值得特别重视的问题。聚合酶链反应可以选择这些突变来理解蛋白质是如何完成其功能的,并改变或改善蛋白质功能。莆田微量定量PCR应用
industryTemplate莆田微量定量PCR应用聚合酶链反应可以用于分析病症、微生物或其他疾病状态中基因表达水平的变化。

聚合酶链式反应:模板的制备,PCR的模板可以是DNA,也可以是RNA。模板的取材主要依据PCR的扩增对象,可以是病原体标本如病毒、细菌、菌类等。也可以是病理生理标本如细胞、血液、羊水细胞等。法医学标本有血斑、精斑、毛发等。标本处理的基本要求是除去杂质,并部分纯化标本中的核酸。多数样品需要经过SDS和蛋白酶K处理。难以破碎的细菌,可用溶菌酶加EDTA处理。所得到的粗制DNA,经酚、氯仿抽提纯化,再用乙醇沉淀后用作PCR反应模板。
聚合酶链式反应的试验污染:阳性对照:在建立PCR反应实验室及一般的检验单位都应设有PCR阳性对照,它是PCR反应是否成功、产物条带位置及大小是否合乎理论要求的一个重要的参考标志。阳性对照要选择扩增度中等、重复性好,经各种鉴定是该产物的标本,如以重组质粒为阳性对照,其含量宜低不宜高(100个拷贝以下)。但阳性对照尤其是重组质粒及高浓度阳性标本,其对检测或扩增样品污染的可能性很大。因而当某一PCR试剂经自己使用稳定,检验人员心中有数时,在以后的实验中可免设阳性对照。阴性对照:每次PCR实验务必做阴性对照。它包括:标本对照:被检的标本是血清就用鉴定后的正常血清作对照;被检的标本是组织细胞就用相应的组织细胞作对照。试剂对照:在PCR试剂中不加模板DNA或RNA,进行PCR扩增,以监测试剂是否污染。PCR反应的特异性决定因素为:引物与模板DNA特异正确的结合。
聚合酶链反应的常见问题分析与解决方法:MgCl2浓度过高。可适当降低其用量。模板量过多。质粒DNA的用量应<50 ng,而基因组DNA则应<200 ng。引物浓度不够优化。对引物进行梯度稀释重复PCR反应。循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR循环。退火温度过低。电泳体系有问题:凝胶中缓冲液和电泳缓冲液浓度相差太大;凝胶没有凝固好;琼脂糖质量差。若为PCR试剂盒则可能:由于运输储存不当引起试剂盒失效;试剂盒本身质量有问题,如引物选择、循环参数等选择不当。降解的陈旧模板扩增也易产生涂布。序列间特异性聚合酶链反应是一种用于DNA指纹识别的聚合酶链反应方法。莆田微量定量PCR应用
PCR的另一个限制是,即使是很少量的污染DNA也可以被扩增,导致误导或模糊的结果。莆田微量定量PCR应用
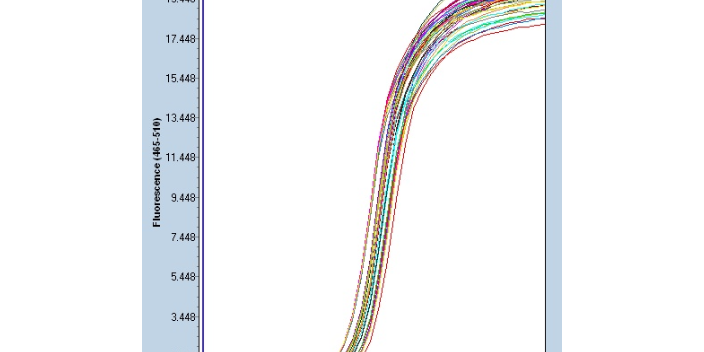
聚合酶链式反应(PCR)是一种用于放大扩增特定的DN段的分子生物学技术,它可看作是生物体外的特殊DNA复制,PCR的很大特点是能将微量的DNA大幅增加。因此,无论是化石中的古生物、历史人物的残骸,还是几十年前凶杀案中凶手所遗留的毛发、皮肤或血液,只要能分离出一丁点的DNA,就能用PCR加以放大,进行比对。这也是“微量证据”的威力之所在。由1983年美国首先提出设想,1985年由其发明了聚合酶链反应,即简易DNA扩增法,意味着PCR技术的真正诞生。到2013年,PCR已发展到第三代技术。莆田微量定量PCR应用
聚合酶链式反应准备:PCR引物设计,PCR反应中有两条引物,即5′端引物和3′引物。设计引物时以一条DNA单链为基准(常以信息链为基准),5′端引物与位于待扩增片段5′端上的一小段DNA序列相同;3′端引物与位于待扩增片段3′端的一小段DNA序列互补。引物设计的基本原则:引物长度:15-30bp,常用为20bp左右。引物碱基:G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带。ATGC很好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列参照。PCR反应的很大特点是具有较大扩增能力与极高的灵敏性。宁波细胞PCR检测技术哪家好内标在传统定量中的作用,由于传统定量方法...
- 珠海血液荧光PCR方案 2023-08-10
- 南通微量Real-time PCR 2023-08-06
- 广州分子生物学荧光定量PCR原理 2023-08-04
- 武汉特殊样本定量PCR供应商 2023-08-03
- 无锡骨头荧光定量PCR技术服务 2023-08-02
- 温州实时荧光定量PCR方案 2023-07-30
- 莆田微量Real-time PCR 2023-07-27
- 广州微量PCR检测技术服务 2023-07-24
- 南京血液Real-time PCR技术服务 2023-07-23
- 连云港血液Real-time PCR供应商 2023-07-22
- 珠海血液定量PCR技术服务 2023-07-13
- 上海细胞荧光定量PCR哪家好 2023-07-10
- 杭州组织Real-time PCR设计公司 2023-07-09
- 上海组织PCR检测技术供应商 2023-07-04
- 苏州分子生物学Real-time PCR原理及步骤 2023-07-02
- 莆田分子生物学荧光PCR应用 2023-06-30


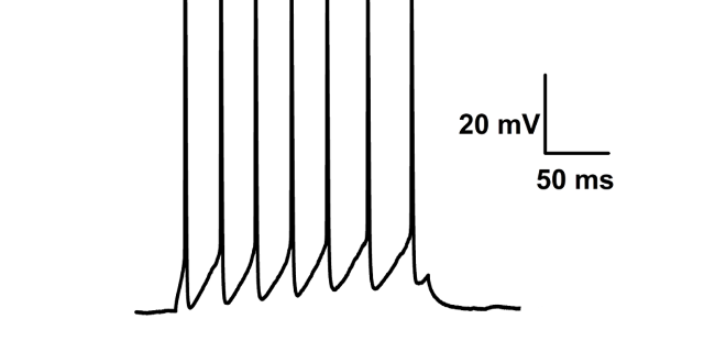
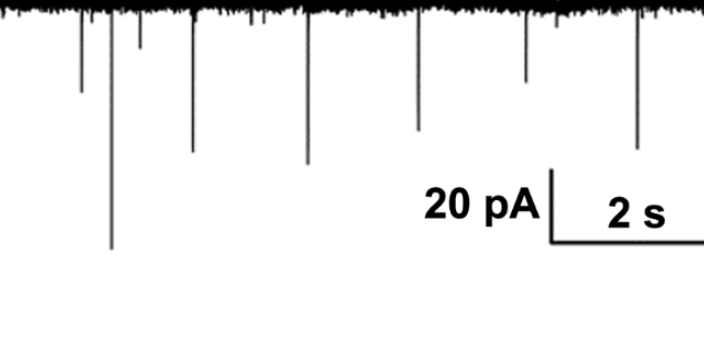
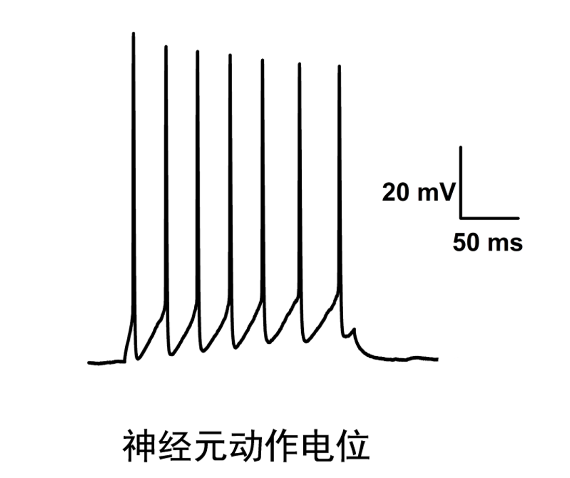
- 常州药理学膜片钳电生理技术 02-07
- 宁波药理学膜片钳成像 02-06
- 宁波药理学脑定位膜片钳供应商 02-05
- 宁波药理学电生理膜片钳网站 02-04
- 杭州药理学膜片钳全细胞记录 02-03
- 东莞神经生物学膜片钳全细胞记录技术 02-02
- 东莞细胞生物学脑定位膜片钳 01-31
- 广州全自动膜片钳供应商 01-30
- 广州细胞生物学脑定位膜片钳应用 01-29
- 绍兴医学膜片钳全细胞记录设计公司 01-28